2017年,诺华公司用于治疗急性淋巴细胞白血病(ALL)的CAR-T疗法Kymriah(Tisagenlecleucel; CTL019)和凯特公司用于治疗大B细胞淋巴瘤的Yescarta(Axicabtagene ciloleucel; KTE-C19)相继被美国FDA相继批准上市,开启了肿瘤免疫治疗新篇章。
然而,在CAR-T的治疗过程中,主要存在以下几种毒副反应及安全风险:(1)细胞因子释放综合征(Cytokine releasesyndrome,CRS);(2)神经毒性;(3)脱靶识别;(4)全身性过敏反应;(5)插入突变;(6)移植物抗宿主病(GVHD)。
目前的临床试验表明,输注CAR-T细胞后最常见的副作用是免疫激活导致的“细胞因子风暴”CRS。CRS是一种非抗原依赖的由于高水平的免疫系统激活产生的一种特殊的临床综合症,在靶向CD19的B细胞白血病CAR-T治疗过程中普遍发生,在单抗药物(例如CD20抗体美罗华以及OKT3抗体等)的临床使用中也经常发生。值得注意的是,CRS在双特异性抗体blinatumomab治疗中也会出现。
CRS的标志是免疫激活导致炎性细胞因子升高,机体免疫细胞大量活化、溶解,导致细胞因子被大量释放,从而引起全身免疫风暴。目前对CRS诊断的临床共识包括:(1)连续发热(>38℃)超过3天;(2)两种细胞因子最大倍增数≥75倍,或一种细胞因子最大倍增数≥250倍;(3)至少有一种临床毒性症状出现,包括低血压、低氧血症(PO2<90%)、神经系统症状(精神状态改变、思维迟钝、抽搐等)。
临床和实验室评价范围从轻度CRS(全身症状和/或2级器官毒性)到严重CRS(sCRS;≥3级器官毒性,需要临床干预和/或危及生命),其临床特征包括:高热,不适,疲劳,肌肉疼痛,恶心,厌食,心动过速/低血压,毛细血管渗漏,心功能不全,肾功能不全,肝功能衰竭和弥散性血管内凝血。在最新版本的常见不良反应事件评价标准(CommonTerminology Criteria for Adverse Events (CTCAE) )中对CRS分级进行了划分(参见表1)。

CRS的发生通常与过继转移的细胞的扩增和进行性免疫激活相关,有证据表明,CRS的严重程度由输注时疾病负担决定,具有高肿瘤负荷的患者经历更多sCRS。在用CD19特异性CAR-T细胞治疗复发/难治性B细胞急性淋巴细胞白血病的患者的报道中,sCRS的发病率范围为19%至43%,其差异可能是由于综合征的临床鉴定,嵌合受体设计和输注细胞表型的不同。
数据显示:CTL019 (Tisagenlecleucel) 编号为B2202 的临床研究(BLA125646)纳入的68例B细胞急性白血病CAR-T治疗患者中,78%(53/68)的患者出现了CRS,其中47%的患者(32/68)发生了3级/4级的sCRS。美国蓝鸟生物以BCMA为靶点的CAR-T 治疗多发性骨髓瘤病人的临床研究中,71%的病人(15/21)发生了CRS,其中9.52% (2/21)发生了3级/4级的sCRS(2017ASCO#3010)。
由此可见,细胞因子释放综合征(CRS)是CAR-T治疗过程中最显著的毒副反应,对CRS发生和程度的预测、“实时”监测、以及针对sCRS采取及时有效的治疗手段成为CAR-T细胞疗法临床治疗中亟待解决的问题。
目前学术界和临床上对CRS的潜在生物学机制知之甚少,深入对CRS的认识和理解将会有助于改善治疗效果,并可能预防或消除CRS严重的并发症。IL-6R抑制剂托珠单抗(tocilizumab)是临床上用于CAR-T细胞输注后治疗sCRS的常用手段,其作用机理在于阻断促炎因子IL-6介导的信号通路(如图1),尽管有效,但其缓解CRS的机制仍不明确,并且目前还不清楚其是否可以用于预防CRS,或者如果使用得太早可能会降低CAR-T细胞的功效。因此,对CRS患者疾病进展的预测对CAR-T细胞治疗至关重要,但目前尚未有研究团队或机构发布CRS的准确预测因子。
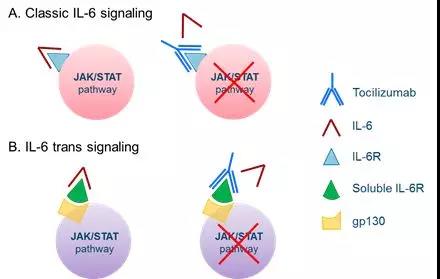
图1 托珠单抗(tocilizumab)抑制IL-6信号示意图
在CAR-T细胞输注后,机体免疫细胞大量活化,炎性细胞因子大量释放。由于CRS是炎症细胞因子超生理水平的直接结果,因此认为血清中细胞因子水平可作为生物标志物来诊断和量化综合征的严重程度。CRS所涉及的细胞因子主要包括IL-6、IFN-γ、TNFα、IL-2、IL-8 和IL-10等。有研究结果表明,CAR-T细胞输注后血清中TNFα,IL-6,IL-8,MCP-1,IFNγ,铁蛋白和CRP水平的升高与严重CRS的发展密切相关(图2)。
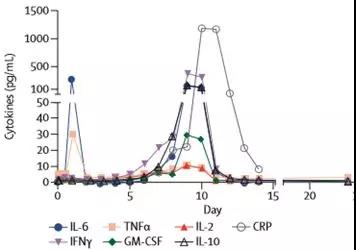
图2 急性淋巴细胞白血病患者接受CAR-T治疗后血清中细胞因子浓度
早期监测血清细胞因子的水平或许有助于对CRS的发生和进展程度进行预测,在CAR-T输注前或早期进行治疗评估对患者CRS控制及预后判断具有重要意义,但目前基于血清细胞因子水平检测的CRS评估体系尚有待完善。
参考文献
[1] Bonifant C L, Jackson H J, Brentjens RJ, et al. Toxicity and management in CAR T-cell therapy[J]. Molecular TherapyOncolytics, 2016, 3:16011.
[2] Teachey, DT, Rheingold, SR, Maude, SL, Zugmaier, G, Barrett, DM,Seif, AE et al. Cytokine release syndrome after blinatumomab treatment relatedto abnormal macrophage activation and ameliorated with cytokine-directedtherapy. Blood 2013, 121:5154–5157.
[3] Daniel W.Lee et.al. Current concepts in the diagnosis and management of cytokine releasesyndrome. Blood 2014 124:188-195.
[4] Maude, SL, Frey, N, Shaw, PA, Aplenc, R,Barrett, DM, Bunin, NJ et al. (2014). Chimeric antigen receptor T cells forsustained remissions in leukemia. N Engl J Med 371:1507–1517.
[5] Davila, ML, Riviere, I, Wang, X, Bartido, S,Park, J, Curran, K et al. (2014). Efficacy and toxicity management of 19-28zCAR T cell therapy in B cell acute lymphoblastic leukemia. Sci Transl Med 6:224ra25.
[6]Lee, DW, Kochenderfer, JN, Stetler-Stevenson, M, Cui, YK, Delbrook, C, Feldman,SA et al. (2015). T cells expressing CD19 chimeric antigen receptors for acutelymphoblastic leukaemia in children and young adults: a phase 1 dose-escalationtrial. Lancet 385:517–528.
[7] GarbersC, Apariciosiegmund S, Rosejohn S. The IL-6/gp130/STAT3 signaling axis: recentadvances towards specific inhibition.[J]. Current Opinion in Immunology, 2015,34:75-82.
[8] Brentjens R J, Rivière I, Park J H, et al.Safety and persistence of adoptively transferred autologous CD19-targeted Tcells in patients with relapsed or chemotherapy refractory B-cellleukemias.[J]. Blood, 2011, 118(18):4817.
[9]Grupp S A, Kalos M, Barrett D, et al. Chimeric Antigen Receptor–Modified TCells for Acute Lymphoid Leukemia[J]. New England Journal of Medicine, 2013,368(16):1509.
[10] Neelapu S S, Tummala S, Kebriaei P, et al.Chimeric antigen receptor T-cell therapy - assessment and management oftoxicities.. Nature Reviews Clinical Oncology, 2017. doi: 10.1038.
[11]Teachey D T, Lacey S F, Shaw P A, et al. Identification of PredictiveBiomarkers for Cytokine Release Syndrome after Chimeric Antigen Receptor T-cellTherapy for Acute Lymphoblastic Leukemia[J]. Cancer Discovery, 2016, 6(6):664.
(此内容版权归金斯瑞生物科技股份有限公司所有)

